11月13日,山东大学孙金鹏教授团队,联合四川大学邵振华团队、上海交通大学医学院李乾团队、山东第一医科大学王越团队在Cell在线发表研究论文“Structural and signaling mechanisms of TAAR1 enabled preferential agonist design”。研究团队系统分析了不同内源性胺类和SEP363856激活TAAR1多种G蛋白信号的特征,解析了TAAR1-Gs/Gq通路激活的分子机制和药理学特征,进而成功开发出同时具有Gs和Gq双激活活性的TAAR1小分子激动剂ZH8651,并在小鼠模型中验证了其改善精神分裂的作用。该研究为靶向TAAR1治疗精神分裂症的候选化合物设计及药物开发改造提供了重要参考(图1)。
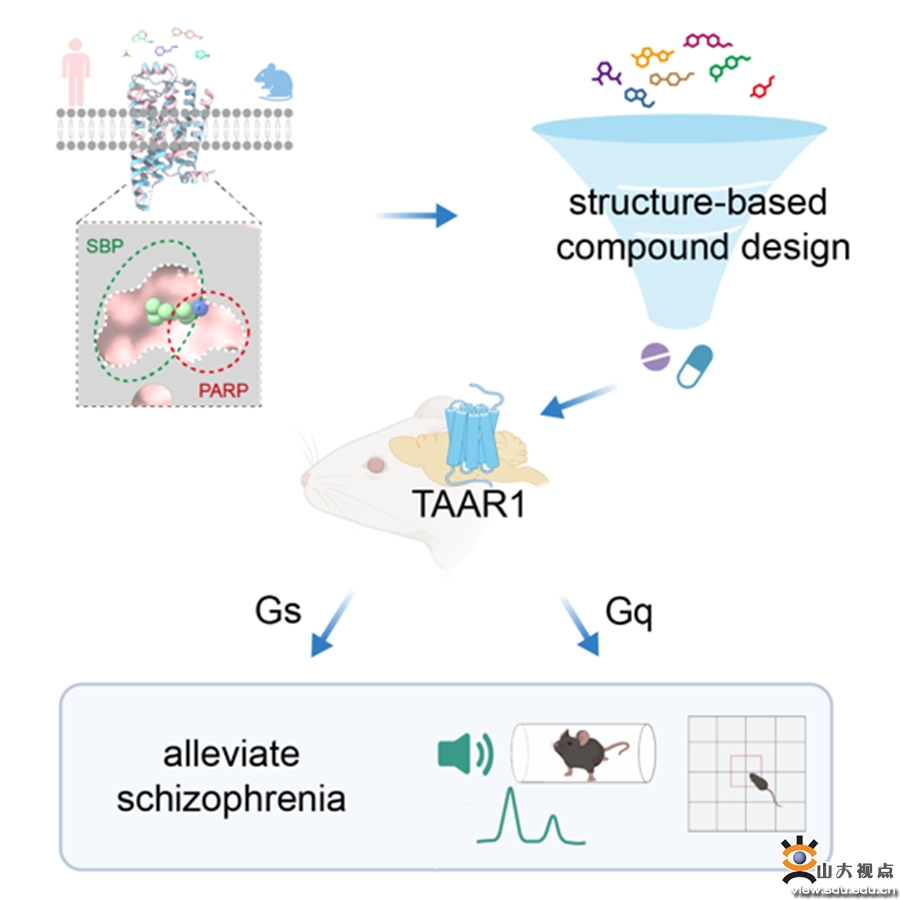
图1. 文章简要示意图
山东大学基础医学院研究生尚攀、荣乃康,讲师姜晶晶,特别资助类博士后程杰,齐鲁医院研究生张鸣晖,药学院研究员康东伟,山东大学生物医学结构表征中心主任齐磊为论文共同第一作者。山东大学教授孙金鹏、杨帆,四川大学研究员邵振华,上海交通大学医学院研究员李乾,山东第一医科大学研究员王越为论文共同通讯作者。
单胺类分子,比如多巴胺、5-羟色胺、肾上腺素等,是哺乳动物中枢神经系统中重要的神经递质,参与多种行为的调节和神经生理功能的调控。除了这些被大家熟知的生物胺类神经递质以外,大脑内还存在一类内源性的胺类分子,其浓度非常低,被称为“痕量胺”,包括苯乙胺(PEA)、色胺、酪胺等。2001年研究发现,痕量胺能够特异性激活一类受体,这些受体被命名为痕量胺相关受体(Trace Amine-Associated Receptor,TAAR)。TAAR家族在哺乳动物中可以分为两个进化枝:Clade I(包括TAAR1-4) 和 Clade II(包括TAAR5-9),其中,除TAAR1以外,其余TAAR家族成员均在嗅上皮组织中高表达,属于一类嗅觉受体亚家族,称为嗅觉TAAR。与嗅觉TAAR不同,TAAR1主要表达在大脑的单胺能神经核团,能够被多种痕量胺激活,并且与药物成瘾、注意力缺陷多动症、精神分裂症等多种精神疾病相关,2020年新英格兰医学杂志报道了一种靶向TAAR1治疗精神分裂症的小分子SEP363856(又名Ulotaront),改善症状的同时可以避免严重不良反应,这为开发精神分裂症的新型治疗方法提供了线索。靶向TAAR1开发药物具有巨大的治疗潜力,因此系统研究TAAR1分子识别和信号多样性的机制和药理学基础具有重要意义。
该研究主要发现包括:
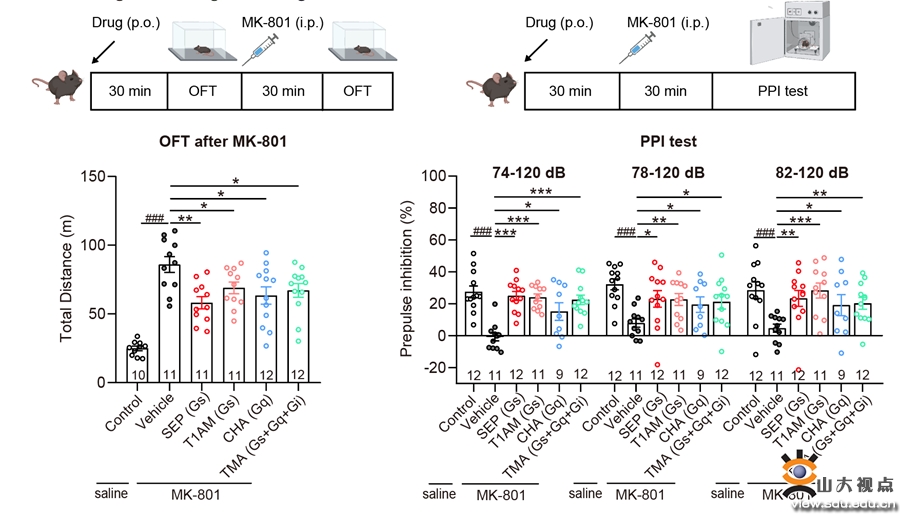
图2. TAAR1不同G蛋白信号通路激动剂对精神分裂样症状的作用
(1)明确了多种内源性胺类代谢物(endogenous amine-containing metabolites, EAM)激活TAAR1下游信号的通路多样性及其在精神分裂症中的作用。研究发现,在动物实验中,不仅激活Gs通路的SEP-363856能够缓解MK-801诱导的精神分裂样症状,激活Gq信号通路的CHA也能够缓解该症状(图2)。在分别应用Taar1-/-小鼠和Gq抑制剂后,CHA对精神分裂的缓解作用明显减弱。这提示TAAR1介导的Gq信号通路对MK801诱导的精神分裂样症状具有改善作用。
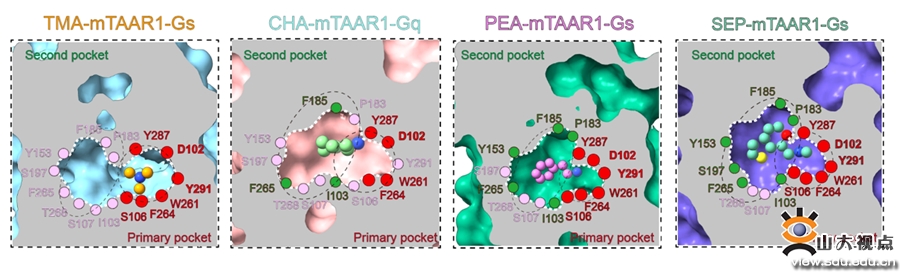
图3. TAAR1的配体识别口袋
(2)解析了EAM和临床三期药物SEP激活m/hTAAR1-Gs/Gq的分子机制。研究团队通过解析多个复合物的配体识别机制,发现了胺类识别的结合口袋(primary amine recognition pocket, PARP)和第二结合口袋(second binding pocket,SBP),揭示了TAAR1不同于嗅觉TAAR的配体结合域(图3)。
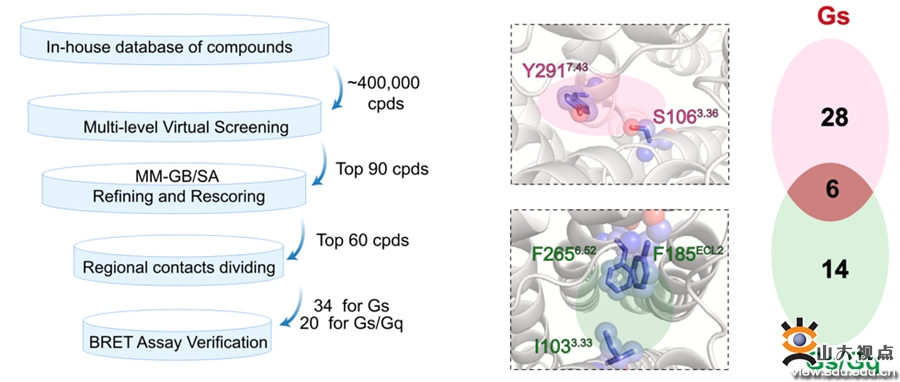
图4. 基于结构开发TAAR1激动剂的流程图
(3)阐明了TAAR1偶联Gs和Gq信号通路的关键氨基酸和信号传递途径。研究团队进一步找到了激活Gs和Gq通路的关键氨基酸位点,将S1063.36和Y2917.43作为Gs选择性激动剂的筛选位点,而I1033.33、F185ECL2和F2656.52作为Gs/Gq双效激动剂的关键筛选位点(图4)。
(4)开发了靶向TAAR1的Gs偶联、Gq偶联以及Gs/Gq双偶联的高亲和力激动剂,并验证了其缓解精神分裂症的作用。研究团队设计了“区域接触划分”策略,通过虚拟筛选和细胞生化实验验证,得到了TAAR1的Gs偶联激动剂ZH8667、Gq偶联激动剂ZH8659、Gs/Gq双偶联激动剂ZH8651。以SEP作为对照,ZH8659和ZH8651均能改善MK -801诱导的小鼠精神分裂样症状,其效果与SEP相似,并且ZH8659和ZH8651均没有引起基础活动减少,避免了潜在的不良反应。
综上,该研究为更好地理解脑内哪些系统参与精神分裂症提供了参考,同时有助于靶向TAAR1抗精神疾病药物先导化合物的开发。
孙金鹏教授课题组长期聚焦于微环境药理学,系统性研究了膜受体感知微环境并调控生理功能的机制,以通讯作者在Nature(x7),Science(封面),Cell(x2,一篇封面),Cell Metab,Nat Metab,Nat Chem Biol(x3),PNAS(x6),Nat Commu(x7)等杂志发表文章70余篇。
原文链接:https://doi.org/10.1016/j.cell.2023.10.014